Von Professor Volker Busskamp, Universitätsklinikum Bonn
Im Rahmen meiner Professur zur Erforschung und Behandlung von degenerativen Netzhauterkrankungen benutzen wir Modellsysteme im Labor. Zum einen sind es Mauslinien, die monogenetische Formen von Retinitis pigmentosa (RP) sehr gut widerspiegeln. Jedoch kommen Mausmodelle hinsichtlich der Zapfen und insbesondere hinsichtlich der Makula an ihre Grenzen. In der Netzhautforschung ist allgemein bekannt, dass multifaktorielle Erkrankungen wie die Altersabhängige Makula-Degeneration (AMD), die auf genetische Risikofaktoren und Umwelteinflüsse zurückzuführen sind, schlecht in Mausmodellen rekapituliert werden können. Dies ist auch der Tatsache geschuldet, dass Nagetiere keine Makula haben. Dazu wurden in den vergangenen Jahren menschliche Netzhautorganoide entwickelt, welche jedoch noch nicht die natürliche Zellkomposition sowie deren Morphologie und Funktion aufweisen. An der Stelle treibt mein Team die Stammzelltechnologie voran, sodass der Netzhautforschung bald bessere Organoide zur Verfügung stehen.
Arbeitsprogramm: Die Technik für das Herstellen retinaler Organoide haben wir durch Hilfe von Professor Botond Roskas Team vom IOB in Basel in unser Labor transferieren können. Derzeit arbeiten wir an der Vaskularisierung der Netzhautorganoide, um die Versorgung auch im Inneren des Organoids mit Nährstoffen sicherzustellen. Das langfristige Ziel ist es, auch größere und weiter ausdifferenzierte Organoide herstellen zu können. Zur Visualisierung der neu eingebrachten Gefäße nutzen wir fluoreszierende Farbstoffe, um die Integration in das retinale Gewebe zu überprüfen. Um dies auch an wachsenden Organoiden prüfen zu können, ist unbedingt ein Live Cell Imaging Mikroskop mit Fluoreszenz notwendig, das den Fortschritt aufzeichnet.
Fluoreszenzmikroskopie ist auch essentiell für unsere Tierversuche. Zum einen kann direkt nach der Präparation der Netzhaut die Integration des subretinal injizierten Stoffes untersucht und genau lokalisiert werden. Das ist für anschließende Experimente enorm wichtig, um zielgenau das behandelte Gewebe untersuchen zu können. Zum anderen ist im Anschluss an die Fixierung der Retinae und den angefertigten Gewebeschnitten das Mikroskop erneut im Einsatz. Dann kann auf zellulärer Ebene die Expression des eingebrachten Gens in die Mausretina untersucht werden, aber auch durch das Anfärben mit Fluoreszenzfarbstoffen anderer Zelltypen der Retinae bestimmt werden. Das ist ausschlaggebend für die Einordnung des Erfolgs der Gentherapie bei den Mausmodellen, um sie für klinische Studien beim Menschen zu evaluieren.
Zusammenfassend sind wir der Pro Retina – Stiftung zur Verhütung von Blindheit sehr dankbar für die Unterstützung bei der Anschaffung eines fortschrittlichen Fluoreszenzmikroskops, welches im täglichen Einsatz sein wird und womit wir unsere Forschung qualitativ hochwertig dokumentieren können.
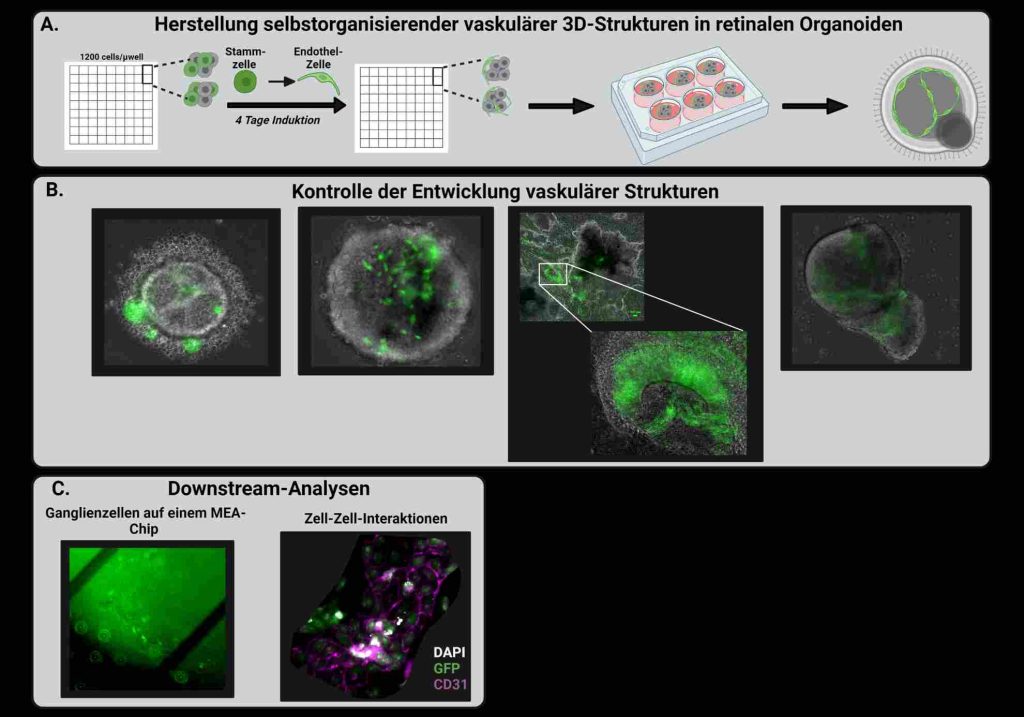
Abbildung: Experimentelles Design zur Veranschaulichung der Generation vaskularisierter 3D-Organoide aus humanen induzierten pluripotenten Stammzellen (hiPSCs). A.: Zur Herstellung vaskularisierter retinaler Organoide werden hiPSCs Zellen (grau) zusammen Endothelzell-Vorläufern (grün) zur Selbstorganisation verwendet. B.: Mit dem Durchlichtmikroskop kann die Vaskularisierung im wachsenden Organoid dokumentiert werden. C.: Zur Darstellung von Ganglienzellen und Organoiden auf MEAs können Durchlicht- und Auflicht-Bilder erstellt werden, um die Positionierung anzupassen. Außerdem können die Zell-Zell-Interaktion zwischen den Endothelzellen und auch in späteren Stadien die geformten Lumen im Organoid untersucht werden (erstellt mit BioRender.com).
Anmerkung der Pro Retina – Stiftung zur Verhütung von Blindheit
Die Stiftung unterstützt dieses Projekt mit rund 48.000 Euro. Die Förderung ist absolut notwendig, um innovative Therapien entwickeln zu können, die Augenlicht erhalten sollen. Um dieser wichtigen Aufgabe nachzukommen, sind wir dringend auf Spenden angewiesen und bitten um Ihre Unterstützung.
Spendenkonto: Sparkasse Dachau, IBAN DE51 7005 1540 0000 0793 27
Verwendungszweck: Forschungsförderung